Tanggal
Praktikum : 15 Oktober 2019
Tujuan :
Mengetahui kerja enzim pada proses pencernaan di dalam mulut dan Mengukur kerja
enzim amilase dalam beberapa lingkungan suhu yang berbeda
A.
Landasan Teori
Enzim merupakan substansi penting dalams setiap reaksi kimia dalam
sel. Orang yang pertama menemukan enzim adalah Edward dan Hans Buchner. Oleh
karena enzim dapat mempercepat reaksi kimia, berarti enzim merupakan rekasi
katalis. Enzim merupakan katalisator organic dan dibuat dalam sel makhluk hidup
sehingga enzim disebut juga biokatalisator (Cartono, 2004).
Dengan tidak
adanya enzim. Lalu lintas kimiawi melalui jalur-jalur metabolisme akan menjadi
sangat macet. (Campbell,dkk. 2002: 98).
Enzim dikenal
untuk pertama kalinya sebagai protein oleh sumber pada tahun 1926 yang telah
berhasil mengisolasi urease dari ‘kara pedang’ (Jack bean). Urease adalah enzim
yang dapat menguraikan urea menjadi CO2 dan NH3 beberapa tahun kemudian
Nhorthrop dan Kunitz dapat mengisolasi pepsin, tripsin, kimotripsin.
Selanjutnya makin banyak enzim yang telah dapat diisolasi dan telah dibuktikan
bahwa enzim tersebut ialah suatu protein (Poedjiadi, 2004:141).
Enzim
adalah protein yang berperan sebagai katalis dalam metabolisme makhluk hidup.
Enzim berperan untuk mempercepat reaksi kimia yang terjadi di dalam tubuh
makhluk hidup, tetapi enzim itu sendiri tidak ikut bereaksi. Enzim berperan secara lebih spesifik dalam hal menentukan
reaksi mana yang akan dipacu dibandingkan dengan katalisator anorganik sehingga
ribuan reaksi dapat berlangsung dengan tidak menghasilkan produk sampingan yang
beracun (Anonim, 2009: html).
Enzim adalah senyawa organik yang dihasilkan oleh sel-sel
hidup. Inilah mengapa enzim tersebut katalis hayati atau organik atau sarana
katalitik. Katalis juga menampakan spesifik atau kekhususan. Artinya suatu
katalis tertentu akan berfungsi pada hanya suatu jenis reaksi tertentu saja
(Pelczar dan Chan. 2006: 318)
Ada
2 (dua) cara kerja enzim :
1. Lock and key (gembok dan anak kunci)
Setiap enzim memiliki sisi aktif
yang tersusun dari sejumlah asam amino. Bentuk sisi aktif ini sangat spesifik,
sehingga hanya molekul dengan bentuk tertentu yang dapat menjadi substrat bagi
enzim.
2. Induced fit (induksi pas)
Sisi aktif enzim merupakan bentuk
yang tidak kaku (fleksibel). Ketika substrat memasuki sisi aktif enzim, bentuk
sisi aktif berubah bentuk sesuai dengan bentuk substrat kemudian terbentuk
kompleks enzim-substrat. Pada saat produk sudah terlepas dari kompleks, maka
enzim lepas dan kembali bereaksi dengan substrat yang lain. Enzim bekerja
dengan cara mengkatalis reaksi sehingga meningkatkan kecepatan reaksi yang
dilakukan dengan menurunkan energi aktivasi (energi yang dibutuhkan untuk
reaksi) (Anonim, 2009: html).
Kerja enzim dipengaruhi oleh beberapa faktor diantaranya
ialah:
1. Suhu, semakin tinggi suhu, kerja
enzim juga akan meningkat
2. pH, pengaruh pH terhadap suatu enzim
bervariasi tergantung jenisnya
3. Konsentrasi substart, semakin tinggi
konsentrasi substrat, semakin meningkat juga kerja enzim tetapi akan mencapai
titik maksimal pada konsentrasi tertentu.
4. Konsentrasi enzim, semakin tinggi
konsentrasi enzim, semakin meningkat juga kerja enzim
5. Adanya aktivator. Aktivator
merupakan zat yang memicu kerja enzim
6.Adanya inhibitor, inhibitor
merupakan zat yang menghambat kerja enzim.
(http://fionaangelina.com/2008/09/14/enzim/)
Fungsi suatu enzim ialah sebagai katalis untuk proses
biokimia yang terjadi di dalam sel maupun di luar sel (Poedjiadi, 2004:143).
Dari hal tersebut, maka dikenal dua tipe enzim, yaitu enzim
ekstra seluler, atau eksoenzim (berfungsi di luar sel) dan enzim intraseluler,
atau endoenzim (berfungsi di dalam sel). (Michael J. Pelczar dan E.C.S.Chan.
2006:318).
Cara kerja enzim adalah dengan membentuk senyawa
enzim-substrat, kemudian menghasilkan suatu produk tanpa merubah senyawa enzim
itu sendiri, setelah produk terbentuk maka enzim akan melepaskna diri untuk
membentuk senyawa baru dengan substrat yang lain. Enzim digolongkan menurut
reaksi yang diikutinya, sedangkan masing-masing enzim diberi nama menurut nama
substratnya, enzim dibagi dalam enam kelompok golongan besar, yaitu:
1. Oksidoreduktase
Enzim-enzim
yang termasuk golongan ini dapat dibagi dalam dua bagian yaitu dehidrogenase
dan oksidase. Dehidrogenase bekerja pada reaksi-reaksi dehidrogenase, yaitu
reaksi pengambilan atom hidrogen dari suatu senyawa (donor). Hidrogen yang
dilepas diterima oleh senyawa lain (akseptor). Enzim-enzim oksidate juga
sebagai katalis pada reaksi pengambilan hidrogen dari suatu substrat (Poedjiadi,
2004:152).
2. Transferase
Enzim yang termasuk golongan ini
bekerja sebagai katalis pada reaksi pemindahan suatu gugus dari suatu senyawa
kepada senyawa lain. Enzim yang termasuk golongan ini ialah metiltrasferase,
hidroksimetiltransferase, karboksiltransferase, dll
3. Hidrolase
Enzim yang termasuk golongan iini
bekerja sebagai katalis pada reaksi hidrolisis. Enzim yang termasuk golongan
ini ialah esterase, lipase, amilase, dll
4. Isomerase
Bekerja pada reaksi perubahan
intramolekuler. Contoh yang termasuk enzim ini ialah ribulosafosfat epimerase
dan glukosa fosfat isomerase.
5. Ligase
Bekerja pada reaksi-reaksi
penggabungan dua molekul. Oleh karena itu enzim tersebut dinamakan sintesase,
ikatan yang terbentuk dari penggabungan tersebut adalah ikatan C-O, C-S, C-N
atau C-C. Contoh enzim golongan ini antara lain glutamin sintetase dan piruvat
karboksilase (Poedjiadi, 2004:153-157).
B.
Alat dan Bahan
Bahan
|
Alat
|
1.
Saliva
2.
Larutan Almunium
3.
Larutan Iod
4.
Larutan Benedict
5.
Es dan air es
6.
Lugol
7.
Kue Crackers
8.
Water bath
|
1.
Beker gelas 25 ml
2.
Tabung reaksi
3.
Pipet
4.
Batang pengaduk kaca
5.
Gelas Ukur
6.
Plat tetes
7.
Lumpang dan alu porselin
8.
Bunsen spirtus + kaki tiga + kasa
9.
Almunium foil
10.
Termometer
|
C.
Langkah Kerja
Cara kerja amylase pada proses pencernaan
didalam mulut
Cara kerja amylase pada beberapa suhu lingkungan
Setiap kelompok mengumpulkan filtrate saliva 2 ml. saliva tersebut
dikumulkan dalam sebuah beker glass dan dilakukan homogenisasi. Sediakan water
bath yang dipasang suuhu 5 0C, 150C, 25 0C, 35
0C, 45 0C dan 55 0C. kemudian ke dalam 6 bauh
tabung reaksi yang bersih dimasukkan masing-masing 20 ml larutan amilum, lalu
diatur seperti berikut:
Ø Tabung reaksi 1 disimpan pada suhu 5 0C (es)
Ø Tabung reaksi 2 disimpan pada suhu 15 0C (air es)
Ø Tabung reaksi 3 disimpan pada suhu 25 0C (suhu ruang)
Ø Tabung reaksi 4 disimpan pada suhu 35 0C (water bath)
Ø Tabung reaksi 5 disimpan pada suhu 45 0C (Bunsen)
Ø Tabung reaksi 6 disimpan pada suhu 55 0C (Bunsen)
Setelah dibiarkan 10 menit, masukkan ke dalam masing-masing reaksi
diatas 0,5 ml (10 tetes) saliva. Catatlah waktu saat memasukkannya. Dengan
interval waktu 2 menit, lakukanlah uji Benedit bersama-sama uji iod terhadap
larutan amilum yang ada kedalam enam tabung diatas. Catatlah saat tercapainya
titk akromatis untuk keenam macam suhu. Selama berlangsung percobaan, tabug
rekasi tidak boleh dikeluakan dari water bath, ada suhu water bath harus dijaga
agar tetap konstan.
Setelah percobaan selesai buatlah grafik yang menunjukan hubungan
antara temperature dan kerja enzim amilase. Silahkan diskusikan apabila
percobaan yang anda peroleh tidak sesuai dengan yang diharapkan.
D.
Hasil Pengamatan dan Pembahasan
Tabel. 1 Kerja enzim amilase pada proses pencernaan
didalam mulut
No
|
Waktu Pengunyahan
|
Warna
|
|
Setelah ditetesi iodin
|
Setelah ditetesi iodin (30 menit)
|
||
1
|
Ditumbuk
|
Coklat pudar
|
Hitam kecoklatan
|
2
|
30’’
|
Coklat pudar
|
Hitam kecoklatan
|
3
|
1’
|
Coklat
|
Hitam kecoklatan
|
4
|
2’
|
Coklat
|
Hitam keunguan
|
5
|
3’
|
Coklat pekat
|
Hitam keunguan
|
6
|
4’
|
Coklat kehitaman
|
Hitam
|
7
|
5’
|
Coklat kehitaman
|
Hitam
|
8
|
10’
|
Hitam
|
Hitam pudar
|
Pada pengujian amilum ini digunakan craker asin
sebagai larutan substrat supaya bisa dibedakan rasa atau perubahan yang asalnya
asin menjadi manis. Karena ketika dimulut terdapat enzim amilase yang mampu
menguraikan pati menjadi glukosa.
Pada hasil percobaan warna
substrat amilum yang ditumbuk setelah ditetesi iodin tetap
hitam (warna dari larutan iodin itu sendiri), karena tidak terlibat suatu
enzim. Berbeda halnya dengan warna substrat amilum selama waktu pengunyahan tertentu. Pada awal pengunayahan 30 detik, 2 menit belum ada
reaksi perubahan warna karena enzim masih inaktif (tidak/belum aktif). Pada
pengunyahan selama 2 dan 3 menit disini tampak warna hitam keunguan yang menunjukan semakin lama warna semakin pekat setelah ditetesi iodin, hal
tersebutk adanya kerja enzim amilase pada saliva pada saat pengunyahan
dilakukan, karena semakin lama pengunyahan semakin banyak pati yang terurai
menjadi oligosakarida yang merupakan gula pereduksi yang dapat di deteksi oleh
iodine, seperti yang dikatakan David (1991). Namun pada
pengunyahan selama 4-10 menit warna mulai kembali memudar karena terjadi
denaturasi enzim. Artinya amilum telah terurai menjadi glukosa sehingga ketika
ditetesi iodin larutan substrat memang tidak mengandung amilum. Saliva
mengandung amilase dan lipase yang dihasilkan oleh
kelenjar ludah.
Amilase salivarius mampu menghidrolisis pati dan glikogen menjadi maltosa.
Hasil hidrolisis enzimatiknya berupa sakarida yang sederhana dan dextrin.
Air
liur mengandung air kira-kira 99,5%. Sekitar dua pertiga dari bahan terlarut
dalam air liur merupakan bahan organik dan sepertiganya adalah bahan anorganik.
Cairan air liur mengandung α-amilase yang menghidrolisa ikatan α(1→4) pada
cabang sebelah luar glikogen dan amilopektin menjadi glukosa, sejumlah kecil
maltosa, dan suatu inti tahan hidrolisa yang disebut dekstrin. Hanya sebagian
kecil amilum yang dapat dicema di dalam mulut, oleh karena itu sebaiknya
makanan dikunyah lebih lama untuk memberi kesempatan lebih banyak pemecahan
amilum di rongga mulut (DSC Biokimia FKG UGM 2004).
Larutan yang digunakan
untuk uji amilum pada hasil tabel.1 yaitu larutan iodium. Kegunaan iodium ini
yaitu untuk mendeteksi keberadaan polisakarida, yaitu amilosa. Molekul amilosa
ini membentuk spiral disekitar molekul I2 dan menimbulkan warna ungu
kehitaman (Fasha, 2001). Maka pada larutan amilosa dari craker yang ditumbuk
pun memberikan hasil positif walaupun tidak adanya proses pengunyahan karena
iodium mampu mendeteksi polisakarida.
Sedangkan pada kerja enzim
amilase dengan berbagai suhu lingkungan berbeda menggunakan uji iodin dan uji
benedict. Uji benedict
sendiri digunakan untuk
mendeteksi keberadaan monosakarida dan disakarida yang mengandung gugus aldehid
atau keton pada bahan makanan, gugus aldehid atau keton ini mampu mereduksi
larutan benedict sehingga Cu2+ tereduksi menjadi Cu+. Cu+
ini akan berikatan dengan OH- membentuk CuOH yang
mengendap dan berwarna merah bata (Fasha, 2001).
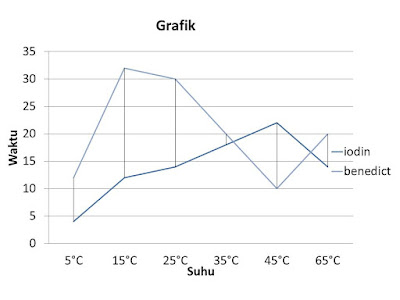
Tabel 2 Kerja Enzim Amilase Pada Beberapa Suhu Lingkungan
|
No
|
Suhu
|
Larutan
Amilum Ditambah
|
Banyak
Tetes (titik akromatis)
|
Waktu
|
Warna
|
|
1
|
5˚C
|
Iod
|
2
tetes
|
4’
|
Coklat
|
|
Benedict
|
6
tetes
|
12’
|
Putih keruh
|
||
|
2
|
15˚C
|
Iod
|
6
tetes
|
12’
|
Coklat pekat
|
|
Benedict
|
16
tetes
|
32’
|
Biru
|
||
|
3
|
25˚C
|
Iod
|
17
tetes
|
14’
|
Coklat
|
|
Benedict
|
15
tetes
|
30’
|
Biru
|
||
|
4
|
35˚C
|
Iod
|
9
tetes
|
18’
|
Coklat pekat
|
|
Benedict
|
12
tetes
|
24’
|
Biru
|
||
|
5
|
45˚C
|
Iod
|
10
tetes
|
20’
|
Coklat
|
|
Benedict
|
11
tetes
|
22’
|
Bening biru
|
||
|
6
|
65˚C
|
Iod
|
7
tetes
|
14’
|
Ungu pudar
|
|
Benedict
|
14
tetes
|
20’
|
Biru muda
|
 Prinsip percobaan pada tabel kedua yaitu menentukan suhu optimum enzim amylase berdasarkan waktu dan indikator banyaknya jumlah iodin dan benedict yang dibutuhkan oleh enzim amylase untuk menghidrolisis amilum menjadi glukosa berdasarkan perubahan warna larutan, dimana pada suhu tertentu akan mempengaruhi berapa lama enzym amilase untuk mencapai titik akromatisnya dengan menggunakan indikator benedict dan iodin.
Prinsip percobaan pada tabel kedua yaitu menentukan suhu optimum enzim amylase berdasarkan waktu dan indikator banyaknya jumlah iodin dan benedict yang dibutuhkan oleh enzim amylase untuk menghidrolisis amilum menjadi glukosa berdasarkan perubahan warna larutan, dimana pada suhu tertentu akan mempengaruhi berapa lama enzym amilase untuk mencapai titik akromatisnya dengan menggunakan indikator benedict dan iodin.
Dari enzim yang disimpan pada keenam suhu berbeda tersebut menunjukan titik akromatis yang berbeda. Titik akromatis adalah titik dimana sudah tidak terjadi perubahan warna lagi. Titik akromatis bisa diartikan sebagai titik dimana terjadi perubahan kimia dari polisakarida menjadi monosakarida (Pelczar, 2006).


Menurut Fasha (2001). Titik akromatis adalah waktu dimana enzim telah mengurai seluruh polisakarida menjadi monosakarida atau disakarida pada suhu dan pH tertentu, yang ditandai dengan tidak terjadi lagi perubahan warna. pada titik akromatis terendah, yang merupakan waktu proses yang paling cepat, disitulah suhu optimal dari enzim tersebut, sedangkan diatas suhu tersebut enzim terurai dan tidak berfungsi. Hal tersebut menunjukan bahwa kerja enzim optimum karena enzim amylase selesai bekerja ketika tidak ada lagi karbohhidrat yang harus di ubah. Fungsi saliva terpusat pada isinya, yaitu amylase saliva (ptyalin) suatu enzim untuk mengurai amilum pada tahap awal (Gunarso, 2005: 27).
Sesuai dengan pernyataan Poedjiadi (2005) bahwa kerja enzim dipengaruhi
oleh beberapa faktor diantaranya: Konsentrasi enzim, konsentrasi substrat, pH,
suhu, inhibitor.
Pada hasil percobaan, enzim amylase bekerja optimum pada suhu 5°C dan 45°C,
hal tersebut sangat tidak sesuai dengan sumber, berdasarkan sumber team
pengajar (2015) sebagian besar enzim manusia memiliki suhu optimal sekitar 35°C
sampai 40°C (mendekati suhu tubuh manusia). Ketidaksesuain dapat terjadi
karena: kurangnya ketelititian dalam mengidentifikasi warna, atau enzym pada
suhu tersebut tidak bekerja samasekali maka tidak menimbulkan perubahan warna
yang menandakan terjadinya reaksi, mungkin warna yang dihasilkan hanya warna dari
larutan iodine atau benedict
A.
Pertanyaan dan
Jawaban pertanyaan
1. Apa kegunaan
uji Iod dan Benedict?
Jawab:
ü Uji iodium ini yaitu untuk mendeteksi keberadaan polisakarida, yaitu amilosa.
Molekul amilosa ini membentuk spiral disekitar molekul I2 dan
menimbulkan warna ungu kehitaman (Fasha, 2001).
ü Sedangkan uji
benedict digunakan untuk menguji adanya glukosa dalam suatu larutan, benedict
digunakan untuk mentes atau memeriksa kehadiran gula monosakarida dalam suatu
cairan monosakarida bersifat reduktor, dengan meneteskan reagen akan menghasilkan
endapan merah bata, karena semakin banyak gula dalam.
2. Apa saliva itu?
Kelenjar apa yang menghasilkannya? dan komponen apa saja yang terkandung dalam
saliva?
Jawab:
Saliva adalah
suatu cairan oral yang kompleks, yang tidak berwarna yang terdiri atas campuran
sekresi dari kelenjar ludah besar dan kecil yang ada pada mukosa oral.
Dihasilkan oleh kelenjar ludah. Saliva disekresi di kelenjar saliva mayor
yang terdiri dari kelenjar parotid, submandibula dan sublingualis dan kelenjar
saliva minor yang terdiri dari kelenjar lingualis, bukalis, labialis, palatinal
dan glossopalatina. Saliva diproduksi oleh masing-masing kelenjar saliva mayor
yang berbeda dalam jumlah dan komposisinya. Kelenjar parotid menghasilkan saliva
yang encer yang kaya akan enzim seperti amilase, protein seperti protein kaya
proline dan glikoprotein lain. Kelenjar submandibular menghasilkan saliva yang
bercampur yaitu serus dan mukus tapi yang lebih dominan adalah serus. Kelenjar
sublingual menghasilkan saliva yang kental namun ditemukan sedikit sel serus.
3.
Faktor-faktor apa saja yang mempengaruhi cara
kerja enzim?
Jawab:
Kerja enzim dipengaruhi oleh beberapa faktor
diantaranya ialah:
a.
Suhu, semakin tinggi suhu, kerja enzim juga
akan meningkat
b.
pH, pengaruh pH terhadap suatu enzim bervariasi
tergantung jenisnya
c.
Konsentrasi substart, semakin tinggi
konsentrasi substrat, semakin meningkat juga kerja enzim tetapi akan mencapai
titik maksimal pada konsentrasi tertentu.
d.
Konsentrasi enzim, semakin tinggi konsentrasi
enzim, semakin meningkat juga kerja enzim
e.
Adanya aktivator. Aktivator merupakan zat yang
memicu kerja enzim
f.
Adanya inhibitor, inhibitor merupakan zat yang
menghambat kerja enzim
4. Apa yang
dimaksud titik akromatis?
Jawab:
Titik akromatis
adalah titik dimana sudah tidak terjadi perubahan warna lagi. Pada uji benedict
titik akromatis bisa diartikan sebagai titik dimana terjadi perubahan kimia
dari polisakarida menjadi monosakarida.
5. Berapa suhu optimumkerja enzim amilase berdasarkan hasil percobaan?
Bandingkan dengan sumber literatur!
Jawab:
 Berdasarkan percobaan suhu optimum kerja
enzim amilase adalah 350C dengan ditandai intensitas perbedaan
kepekatan dari 2 menit pertama sampai 2 menit ke 15, sedangkan berdasarkan
sumber literature suhu optimum enzim itu 300C - 400C.
Karena enzim akan mengalami denaturasi apabila berada dalam suhu yang terlalu
tinggi.
Berdasarkan percobaan suhu optimum kerja
enzim amilase adalah 350C dengan ditandai intensitas perbedaan
kepekatan dari 2 menit pertama sampai 2 menit ke 15, sedangkan berdasarkan
sumber literature suhu optimum enzim itu 300C - 400C.
Karena enzim akan mengalami denaturasi apabila berada dalam suhu yang terlalu
tinggi.
6. Buatlah grafik yang menunjukan suhu optimum untuk aktifitas kerja enzim
amilase---suhu terhadap interval waktu!
7. Buatlah grafik yang menggambarkan titik akromatis!
Jawab:
1.
Uraikan tahapan
hidrolisis amilum oleh enzim amilase!
Jawab:
Tahap
hidrolisis amilum
↓
Amilum
↓
↓
Amilodekstrin
↓
↓
Eritrodekstrin
↓
↓
Akrodekstrin
↓
↓
Maltosa
A.
Simpulan
Berdasarkan hasil pengamatan titik akromatis
paling tinggi terjadi pada suhu 65˚C, semakin tinggi suhu maka enzim tidak akan
bekerja secara optimal. Sampai pada suatu titik, kecepatan suatu reaksi
enzimatik meningkat sejalan dengan meningkatnya suhu. Sebagian disebabkan
karena substrat akan bertubrukan dengan tempat aktif lebih sering ketika
molekul itu beregrak lebih cepat. Namun demikian diluar suhu itu, kecepatan
rekasi enzimatik akan menurun drastis, sehingga molekul protein itu akan mengalami
denaturasi.
Jadi dapat disimpulkan bahwa enzim amilase akan
optimum pada suhu 35˚C sampai 40˚C, karena suhu tersebut mendekati suhu tubuh
manusia yaitu 37˚C. Yang mana enzim amylase dihasilkan dari
campuran sekresi dari kelenjar ludah besar dan kecil yang ada pada mukosa oral
yang ada pada manusia dan hewan mamalia.
B.
Daftar Pustaka
§ Poedjiadi, Anna dan Supriyanti, Titin. 2005. Dasar-dasar
Biokimia. Jakarta: UI-Press
§ Campbel, dkk. 2002. Biology ilid I.
Jakarta: Erlangga
§ Cartono. 2004. Biologi Umum. Bandung: Prisma Press.
§ Fasha, C.I. 2001. Laporan
Praktikum I Pencernaan. Laboratorium Fisiologi Hewan Departemen Biologi
Institut Teknologi Bandung: Bandung
§ Gunarso,
Darmadi, Suripto.2005. Fisiologi Hewan. Jakarta: Universitas Terbuka
§ Michael J. Pelczar dan E.C.S. Chan. 2006. Dasar-dasar
Mikrobiologi. Jakarta: UI-Press.
§ Tim Pengajar.
2015. Panduan Praktikum Fisiologi Hewan. Bandung: UIN Bandung
§ http://belajar-indah.blogspot.com/2009/08/pengertian-enzim.html/akses
tanggal 9-11-15; pukul 22:00




This comment has been removed by the author.
ReplyDeleteGood job.
ReplyDeleteSangat membantu👍
ReplyDeleteIlmu baru lagi maasyaa Allah,, syukran ibu😊😊
ReplyDeleteMakasih ibu untuk ilmunya😊
ReplyDeleteManfaat banget ilmunya,... Syukran😊🙏
ReplyDeleteSedikit mengerti setelah membaca....
ReplyDeleteJazakillah ibu semoga ilmu yang ibu sebarkan bisa memjadi amal shaleh buat ibu...
Aamiin
Sekarang Alhamdulillah Tahu beberapa tentang Enzim,setelah membacanya😊 dimulai dari orang yang pertama menemukan Enzim,Dua Tipe Enzim,dan Faktor yang memengaruhi Cara kerja Enzim,dan masih banyak lagi.. Alhamdulillah sedikit bisa memahamii😊Syukron Bu🙏
ReplyDeleteDapet ilmu baru:)
ReplyDeleteMakasih banyak
Sekarang Alhamdulillah Tahu beberapa tentang Enzim,setelah membacanya😊 dimulai dari orang yang pertama menemukan Enzim,Dua Tipe Enzim,dan Faktor yang memengaruhi Cara kerja Enzim,dan masih banyak lagi.. Alhamdulillah sedikit bisa memahamii😊Syukron Bu🙏
ReplyDeleteManfaat banget Bu ilmu nya
ReplyDeleteAlhamdulilah berkat membaca artikel ini saya jadi tahu sedikit sedikit tentang Enzim Syukron Ibu😊
ReplyDeleteSyukron Bu🙏sangat membantu😊👍
ReplyDeleteLebih baik terangkan dri pda di baca mh hhe
ReplyDeleteSangat membantuu👍☺
ReplyDeleteSangat bermanfaat:)
ReplyDeleteSangat membantu
ReplyDelete-Rsha
Alhamdulillah saya mendapatkan ilmu banyak makasih banyak bu😊
ReplyDeleteGood job👍
ReplyDeleteTerimakasih Untuk Pembahasan Materinya😉🌻
ReplyDeleteIbu sangat pintarr
ReplyDeleteTerimakasih banyak bu atas ilmunya sangat bermanfaat sekali😊
ReplyDeletesekarang aku mengerrtii tentang enzimm walaupun sedikkitt tpikan bermanfaatyh buuu...☺
ReplyDeleteTerimakasih Atas Semua Ilmu Yang Ibu Berikan Kepada Kami Semoga Bermanfaat
ReplyDeleteThanks for you queen teacher:)
ReplyDeleteSangat membantu dan sangat bermanfaat
ReplyDeleteTerimakasih bu👍